研究概要
本研究室では、固体中のイオンの動きに着目した研究を行っています。具体的には、固体中をイオンのみが高速で移動する「固体電解質材料」や、イオンと電子が同時に移動する「イオン-電子混合伝導性材料」を取り扱っています。これらの材料は、リチウムイオン電池の電極材料として利用できます。さらに従来のリチウムイオン電池に用いられている電解質溶液を「固体電解質」で置き換えることにより、全てが固体で形成された「全固体電池」を構成することができます。この全固体電池は次世代蓄電池として期待されています。本研究室はJSTが推進するGteXプロジェクト「高エネルギー密度・高安全な硫化物型全固体電池の開発」に参画しています。
全固体電池
「リチウムイオン電池の開発」の功績により、John B. Boodenough 先生、M. Stanley Whittingham 先生、吉野 彰 先生が2019年のノーベル化学賞を受賞されたことはよくご存じだと思います。先生方が開発されたリチウムイオン電池(LIB)は、携帯電話の電源から電気自動車の動力源に至るまで、日常生活のあらゆる面において利用されています。
リチウムイオン蓄電池の構成をFig.1に示します。
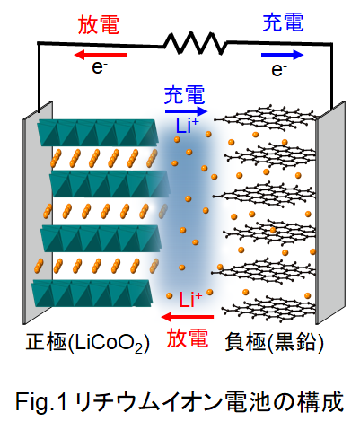
通常のLIBでは、正極活物質として層状岩塩型構造を有するコバルト酸リチウム(LiCoO2)のような遷移金属酸化物を用い、負極活物質には層状構造を有する黒鉛(C)が用いられています。また、正極と負極の間には、リチウムイオン(Li+)が移動できるようにリチウム塩を溶かした電解質溶液が配置されています。電池を充電する場合は、正極のLiCoO2からLi+イオンが引き抜かれて、電解質溶液に移ります。これと同時に負極である黒鉛の層間にLi+イオンが電解質溶液側から挿入される反応が起こります。電池を放電する場合は、これらの逆反応が起こり、負極である黒鉛の層間からLi+イオンが電解質溶液側に移り、正極であるLiCoO2の層間にLi+イオンが戻っていきます。これがリチウムイオン電池の動作原理になります。
このようにLIBは充放電可能な蓄電池として非常に優秀な蓄電池ですが、未だに解決するべき課題も残っています。この課題に一つは正極と負極の間に配置された電解質溶液に関する課題です。LIBの起電力は3.6V以上になりますので電解質溶液の溶媒として水を用いることはできません(水の電気分解が起こってしまうので...)。そこで通常はプロピレンカーボネート(PC)のような有機溶媒を利用した電解質溶液を用いています。しかしながらこの有機溶媒は可燃性であるため、何かのきっかけで燃えてしまう可能性があります。このため、LIBの安全性には課題が残っているのです。電池が小型の場合は大きな問題になりにくいのですが、電気自動車のように大型の蓄電池を必要とする場合には大きな課題となってきます。そこで、この電解質溶液部分をリチウムイオン伝導性の無機系固体電解質で置き換えることで、このような課題を解決しようとしています。この固体電解質を用いた電池が「全固体電池」です。
本研究室では、このような全固体電池に係る研究・開発を行っています。実験室レベルで試作している全固体電池の構成図をFig.2に示します。
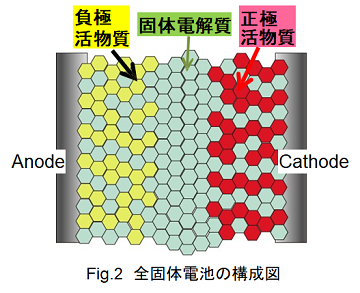
Fig.2では、黄色い粒子として負極活物質を、赤い粒子として正極活物質を、また、緑の粒子として固体電解質粒子を表しています。このようにリチウムイオン電池の電解質溶液部分をを固体電解質で置き換えることにより、全てが固体で構成された全固体電池を構築できます。固体電解質としては、硫化物系の固体電解質や酸化物系の固体電解質を用いることができます。これらの固体電解質は不燃性であるため、電池としては高い安全性が実現できます。
当研究室ではこのような全固体電池に用いるための材料を研究課題としています。
固体電解質の湿式合成
全固体電池を実現する上でキーマテリアルとなるのが固体電解質です。固体電解質に求められる要件としては、高いイオン伝導性のみならず、正極あるいは負極活物質との間の電気化学的な安定性も求められます。現在、最も高いリチウムイオン伝導性を示す材料は、東京工業大学の菅野先生のグループが開発されたLGPS系と呼ばれる一群の化合物です。LGPSの代表的な化学組成はLi10GeP2S12で表される組成であり、室温25℃において、1.2×10-2 Scm-1もの高いイオン伝導性を示します。このイオン伝導度は、従来のLIBで用いられてきた電解質溶液のイオン伝導度に匹敵する値です。さらに、LGPSの硫黄(S)を塩素(Cl)や酸素(O)で置換した化合物が合成されており、これらの化合物は典型的なLGPSであるLi10GeP2S12を超えるリチウムイオン伝導度を示すことが報告されています。
従来、このような硫化物系固体電解質は、原料を石英ガラス管中に真空封入し、高温で加熱するいわゆる固相反応法により合成されてきました。しかしながらこの方法では、一度に合成できる試料は数グラム程度に限られています。仮に全固体電池が製品化され商業的に生産される場合を考えると、固体電解質をより効率的に大量合成する手法が必要となってきます。より簡便かつ大量に固体電解質を生産することが可能な合成法として、有機溶媒を反応媒体として用い、比較的低温で原料を反応させる湿式法が着目されています。湿式法では、反応生成物が溶媒に完全に溶解する液相法と、反応生成物が有機溶媒中に固相で浮遊したエマルション法とに大きく区別されます。ここでは、本研究室で行っているジエーテル系溶媒を用いた湿式法を紹介します。
ここでターゲットとした化合物は、Li7P3S11という硫化物系固体電解質です。この化合物は室温25℃で3.2×10-3 Scm-1というリチウムイオン伝導度を示します。先に紹介したLGPS系ほどではありませんが、非常に高いイオン伝導性を示す化合物です。これをエマルション法で作製した際の合成手順をFig.1に示します。
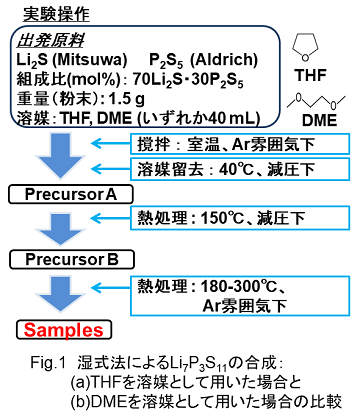
出発原料である硫化リチウム(Li2S)と五硫化二リン(P2S5)を所定量秤量し、これを溶媒とともにねじ口瓶に封入し反応させます。この際、溶媒としてテトラヒドロフラン(THF)を用いた場合とジメチルエーテル(DME)を用いた場合について比較します。反応終了後の試料の様子を比較したものがFig.2になります。いずれの場合も生成物が沈殿としてねじ口瓶の底にたまっていることがわかります。また、溶媒としてTHFを用いたものでは、溶液が黄色に着色していますが、DMEを用いたものでは溶媒は無色透明です。THFを用いたものでは、溶媒が着色していることから、反応生成物の一部が溶媒に溶解していることがわかります。

充分に反応させた後、減圧下で溶媒を除去し前駆体を得ます。この前駆体A(Precursor_A)は、見かけ乾いた状態ですが、固体中に結晶溶媒を抱えている場合があります。これをさらに150℃、減圧下で処理することにより、前駆体B(Precursor_B)を得た後、アルゴン雰囲気下、180~300℃の温度範囲で熱処理することにより、試料を合成しています。このようにして合成した試料のX線回折図をFig.3に示します。
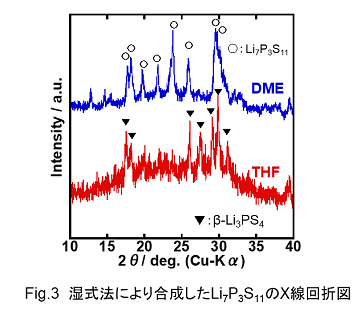
溶媒としてTHFを用いた試料では結晶相としてβ-Li3PS4が析出しているが、DMEを用いた試料では目的化合物であるLi7P3S11結晶相が析出していることがわかります。このように合成過程に用いる溶媒によって、最終的に得られる化合物の結晶相が変化してしまう場合があることがわかります。ここでは、溶媒としてDMEを用いることにより、目的化合物を得ることができました。さらに、得られた化合物について交流電気伝導度を測定した結果をFig.4に示します。
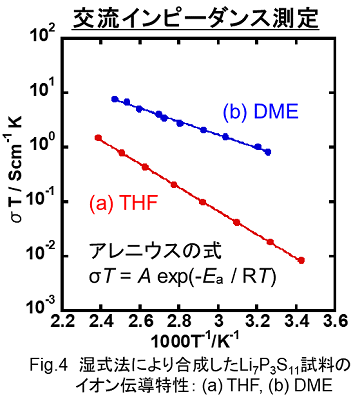
Fig.4の縦軸は、その温度における交流電気伝導度と温度の積の対数を示しており、横軸は温度の逆数を1000倍したものを示しています。各プロットが直線性を示すことから、いわゆるアレニウス式をよく満足していることがわかります。図中(b)で示したDMEを溶媒として用いて合成した試料の方が高いイオン伝導度を示していることがわかります。また直線の傾きからアレニウスの式を用いてイオン伝導の活性化エネルギーを見積もることができます。

このようにして求めた、室温25℃での交流伝導度と伝導の活性化エネルギーをまとめたものをTable.1に示します。THFを溶媒とした試料では、3.9×10-5 Scm-1程度の電気伝導度ですが、DMEを溶媒として合成した試料では2.2×10-3 Scm-1と2桁程度高いイオン伝導性を示すことがわかります。また、通常の固相反応法(ガラス―セラミックス法)で作製したLi7P3S11の値と比較してもそん色ない値を示していることがわかりました。
このように、大量合成を見通すことのできる湿式法を用いても、硫化物系固体電解質が合成可能であること、また、合成に用いる有機溶媒を適切に選択する必要があることが明らかになりました。
全固体電池に適した正極材料
従来のLIBにおいては、コバルト酸リチウム(LiCoO2)のような層状岩塩型構造を有する遷移金属酸化物が主に用いられてきました。このような層状岩塩型構造を有する遷移金属化合物は、金属リチウムに対して4V程度の高い起電力を示すことから非常に有用な化合物です。この層状岩塩型構造の模式図をFig.1に示します。
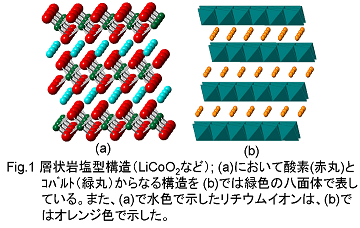
Fig.1(a)の赤い丸が酸素を、緑の小さな丸がコバルト(遷移金属元素)、水色の丸がリチウムイオンを表しています。左の(b)図では、(a)図における酸素とコバルトが作る構造を緑の八面体として示しており、リチウムはオレンジ色で示されています。この酸素とコバルトが作る層と層の間に存在するリチウムが、可逆的に出入りすることにより電池の充放電反応が進行することになります。全固体電池においても、このような層状岩塩型構造を持つ遷移金属酸化物を正極活物質として用いる試みが数多くなされてきました。このような研究の過程において、固体電解質として硫化物系固体電解質を用いた場合、層状岩塩型遷移金属酸化物の特性を十分に引き出すことが難しいことが指摘されました。この原因は、岩塩型遷移金属酸化物と硫化物系固体電解質の界面において、電荷空乏層が生まれるため、あるいは、界面で副反応が起こり遷移金属元素(コバルトなど)が固体電解質側に拡散する現象が起こるためであることが指摘されました。すなわち、正極活物質と固体電解質の間に電気化学的に良好な界面を生み出すことは単純な混合だけでは難しく、工夫が必要であると考えられます。良好な正極活物質-固体電解質界面を形成するために、正極活物質表面に数ナノメートル程度のバッファ層を形成する必要があることが指摘されました。
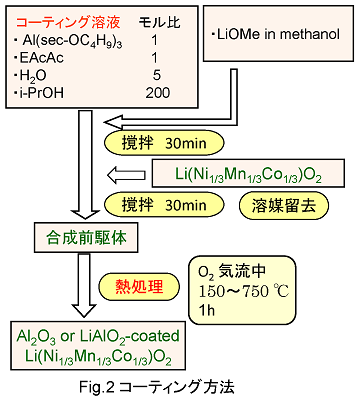
我々は、このようなバッファ層としてLiAlO2を正極活物質表面にコーティングすることを試みました。ここで用いた層状岩塩型遷移金属酸化物は、通常のLiCoO2のコバルトの部分をNiやMnで置換した化合物であり、Li(Ni1/3Mn1/3Co1/3)O2の化学組成(以下NMCを略記します)を持つものです。コーティング手法としてはゾル-ゲル法を用いることにしました。コーティングの手順をFig.2に示します。出発原料として、アルミニウムsec-ブトキシド(Al(sec-OC4H9)3)、エチルアセトアセテート(EAcAc)、水、イソプロパノールを用い、これらをよく撹拌し一部加水分解したところに、リチウムメトキシドのメタノール溶液を加えて、さらによく撹拌します。この溶液に正極活物質であるNMCを加え、さらに撹拌した後、溶媒を溜去することで、合成前駆体を得ます。この合成前駆体を酸素気流中、150℃から750℃の温度で1時間熱処理を行い、LiAlO2がコーティングされたNMCを得ました。
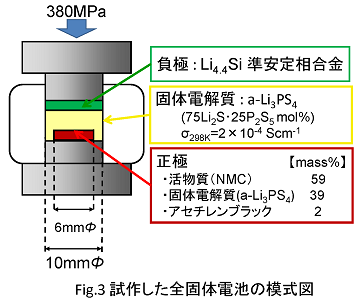
このようにして、LiAlO2をコーティングしたNMCを正極活物質として全固体型の試験電池を作製しました。試験電池の構成をFig.3に示します。固体電解質(SE)として非晶質のLi3PS4を用い、負極にはLi4.4Si準安定相合金を用いました。また正極は、NMC、固体電解質、電子伝導材であるアセチレンブラックを59:39:2の質量比で混合した複合体を用いています。
この試作電池を4.3Vまで充電したところで、電池全体のインピーダンス測定を行いました。得られたインピーダンス曲線の位置例として、コーティング処理を施していないNMCを用いた試験電池のインピーダンスをFig.4に示します。また、図の右側には、固体電解質のみをステンレス電極で挟み込んだセルのインピーダンス曲線、ならびに固体電解質を負極として用いているLi4.4Si準安定相合金電極で挟み込んだセルのインピーダンス曲線を示しています。試験電池のインピーダンスは2つの円弧からなる複雑な形状をしています。一方、固体電解質のみをステンレス電極で挟み込んだセルでは直線しか現れておらず、また、200kHzの周波数のとき実軸と約700Ωの地点で交差しています。また、Li4.4Si準安定相合金電極で挟み込んだセルのインピーダンスは、70Ωから150Ω付近に小さな円弧を描き、さらに低周波数領域はほぼ直線的に発散しています。これらの結果と、試験電池のインピーダンスを比較すると、試験電池でも200kHz付近の周波数で、実軸が70Ωを示す付近から小さな円弧が始まっており、この小さな円弧が1kHzの周波数領域で一旦実軸に近づいていることがわかります。この実軸に近づいた時のインピーダンスが170Ω付近であることから、この小さな円弧が負極のインピーダンスに起因することがわかります。また固体電解質のインピーダンスは200kHzの周波数で実軸を切る地点に帰属できることがわかります。これらのことから、試験電池でみられる大きな円弧は正極活物質-固体電解質界面のインピーダンスに帰属することができます。
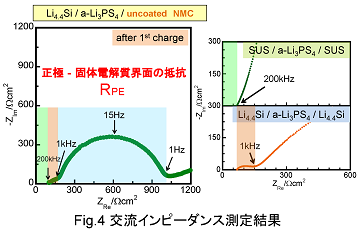
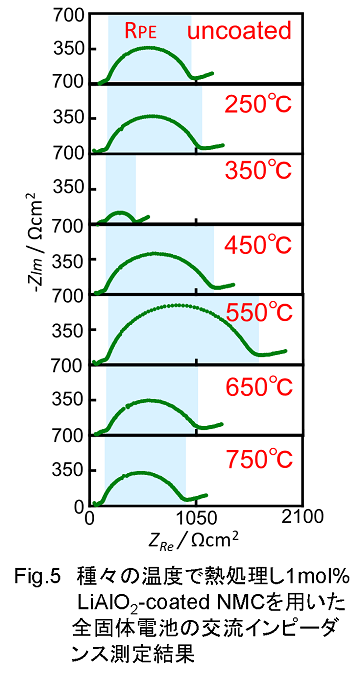
このようにインピーダンス曲線で見た場合に、正極活物質-固体電解質界面の様子が二つ目の比較的大きな円弧に帰属されることを踏まえて、LiAlO2をコーティングしたNMC正極材料の特性を見てみたい。Fig.5には種々の温度で熱処理したLiAlO2コーティングNMCを用いた全固体試験セルのインピーダンスを示しています。LiAlO2の担持量はいずれの試料においても1mol%と一定にしています。この図から明らかなように、ゾル-ゲル法によりコーティングした試料を350℃で熱処理したものが最も小さなインピーダンスを示しています。インピーダンスは電池の内部抵抗を示す指標なので、この値が小さな電池ほど特性が優れていると言えます。このことから、今回のゾル-ゲル法によるコーティングでは350℃で熱処理した試料が最も良い特性を示すことがわかりました。
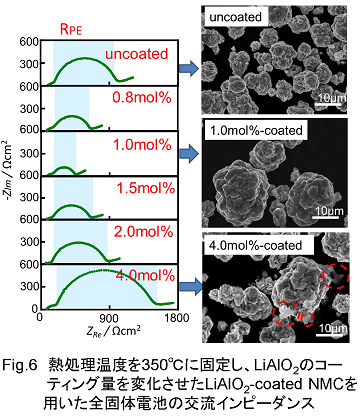
次に、LiAlO2のコーティング量を変化させて作製したLiAlO2-coated NMCを用いた全固体電池セルのインピーダンスをFig.6に示します。いずれの場合も、熱処理温度は350℃に設定しています。これからわかるように、未処理にNMCにコーティング処理を施した場合、コーティング量が増えるとともにインピーダンスは減少し、コーティング量が1.0mol%程度で極小を示した後、さらにコーティング量が増えるとインピーダンスが増加することがわかりました。また、未処理のNMC、1mol% LiAlO2をコーティングしたNMC、4.0mol% LiAlO2をコーティングしたNMCの電子顕微鏡(SEM)写真を図中に併せて示しています。このSEM像からわかるように、未処理のNMCは粒径が約10μm程度ですが、1mol%のLiAlO2をコーティングしたNMCでは、10μ程度の粒子が数個集まってより大きな粒子になっていることがわかります。また、LiAlO2が別の粒子として現れてはいません。一方、4mol%のLiAlO2をコーティングした試料では、10μm程度の粒子がいくつか集まった大きな粒子が存在しており、また、LiAlO2と考えられる粒子(赤い葉選で囲んでいる部分)が存在していることがわかります。これらのことからも、コーティング量としては1.0mol%前後適切であることがわかります。
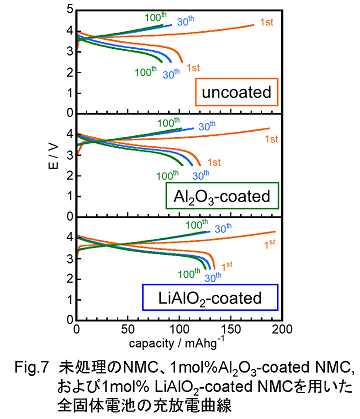
このようにして作製した1.0mol%のLiAO2がコーティングされたNMCを用いて作製した全固体試験電池の充放電曲線をFig.7に示します。図中縦軸は電池電圧、横軸はNMC 1gあたりの電池充放電容量です。電池の充放電試験は、25℃、0.1mA/cm2の一定の電流密度で行い、充放電の打ち切り電圧は、上限を4.3V、下限を2.0Vとしています。また、図中には、コーティング処理を施していないNMCを用いた電池やAl2O3をコーティングしたNMCを用いた電池の充放電曲線も併せて示しています。また、図中、オレンジ色で示した曲線は 1回目の充放電曲線、青色は充放電を30回繰り返した時の曲線、緑色は充放電を100回繰り返した時の充放電曲線になります。このように、LiAlO2をコーティングすることによって充放電容量が大きくなり、NMC 1g当たり、130 mAh/g 程度の値が得られることがわかります。
充放電を繰り返した場合、繰り返し回数が増すにつれて電池容量は少なくなってきます。この現象はいわゆる電池特性の"劣化"ですが、この様子を示したものがFig.8です。Fig.8の縦軸は放電容量を示しており、横軸は充放電サイクル回数です。また、青色は1mol%のLiAlO2をコーティングしたNMCを用いた全固体試験電池、緑色は1mol%のAl2O3をコーティングした試料を用いた電池、赤色は未処理のNMCを用いた電池の充放電試験結果です。未処理のNMCやAl2O3をコーティング処理したNMCを用いた全固体試験電池では、充放電サイクル回数の増加とともに急速に充放電容量が低下しています。一方、1mol%のLiAlO2をコーティングしたNMCを用いた全固体試験電池では、充放電を50回程度繰り返したところまでは徐々に放電容量が減少していくものの、その後充放電を600回繰り返してもほとんど容量が劣化しないことがわかります。
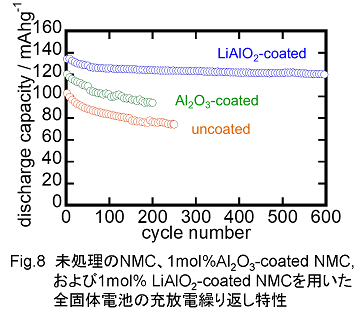
このように正極活物質であるNMCの表面をLiAlO2で修飾することにより、全固体電池の繰り返し充放電による容量劣化をほとんど抑えることができることがわかりました。このような電極活物質表面を改質する技術は、全固体電池を現実に役立つようにするための開発研究においてますます重要になっていくことと思います。
正極材料(NMC)粒子への固体電解質のコーティング
電解質溶液を用いた従来のLIBにおいて、コバルト酸リチウム(LiCoO2)のような層状岩塩型構造を有する遷移金属酸化物が、正極活物質として主に用いられています。このような層状岩塩型構造を有する遷移金属化合物は、金属リチウムに対して4V程度の高い起電力を示すことから非常に有用な化合物です。全固体リチウムイオン電池においてもこのような遷移金属酸化物が用いられています。
全固体リチウムイオン電池の体積当たりのエネルギー密度を上げるためには、正極複合体中にこのような正極活物質をどれほどたくさん詰め込むことができるかが重要になります。その一方で、正極複合体中には、イオン伝導性を担うための固体電解質や、電子伝導性を補助するために炭素繊維などの材料を添加する必要があります。このような補助材料の添加量を抑えることができれば、電池全体としてのエネルギー密度が向上することになります。
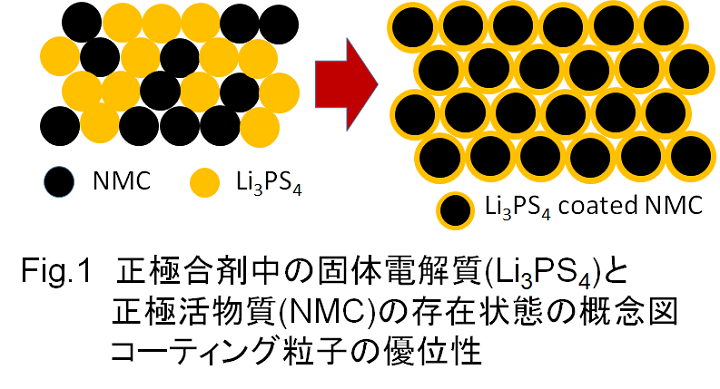
次の図は、正極複合体を模式図として表したものです。図中の黒丸印は正極活物質である層状岩塩型遷移金属酸化物(ここではNMCとしています)を示しており、黄色の丸は固体電解質であるLi3PS3を表しています。左の図は、NMC粒子とLi3PS3粒子を単純に混合した場合の正極複合体を示しています。この場合、Li+イオンは固体電解質の部分を通って移動しますが、すべての活物質に触れるようにイオン伝導経路を構築するためには、多くの固体電解質を添加する必要があります。
一方、右の図はNMC粒子をLi3PS3でコーティングした複合粒子を用いた正極複合体の模式図です。このような構造にすることで、イオン伝導パスを切断することなく、すべてのNMC粒子を有効に活用することができ、正極複合体のエネルギー密度を向上させることができると考えられます。そこで、このようなNMC粒子をLi3PS3でコーティングした複合粒子を作製することを試みました。
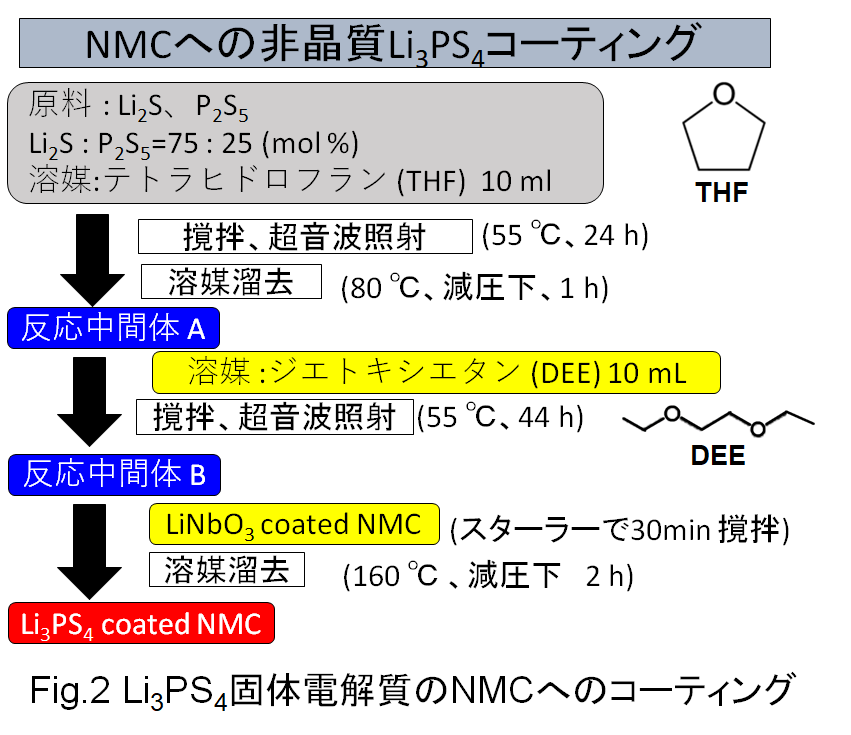
NMC粒子をLi3PS3でコーティングする具体的な手順を図2に示します。先に示した「固体電解質の湿式合成」で解説した手法を用いて、コーティングを行っています。最初に固体電解質の原料である硫化リチウムLi2Sと五硫化二リンP2S5を所定量秤量・混合し、これをテトラヒドロフラン(THF)中で反応させます。さらに溶媒をジエトキシエタン(DEE)に置き換えた後、このスラリーにNMC粒子を加え、撹拌し、固体電解質の前駆体をNMC粒子表面に付着させます。この状態になったスラリーを乾燥させ、さらに160℃で完全に溶媒を取り除いくことにより、非晶質のLi3PS4でコーティングされたNMC粒子を得ています。
このようにして得られた粒子の電子顕微鏡写真をFig.3に示します。上の写真はLi3PS4をコーティングする前のNMC粒子の写真です。NMC粒子は微細に一次粒子が集まって、直径 約5 μm程度の二次粒子を形成しています。このNMC粒子の上に非晶質のLi3PS4をコーティングした粒子の写真を図中下側の写真として示しています。コーティング処理していないNMC粒子と比較して、粒子のエッジ部分が丸みを帯びており、NMC粒子表面にコーティングされたことがうかがえます。

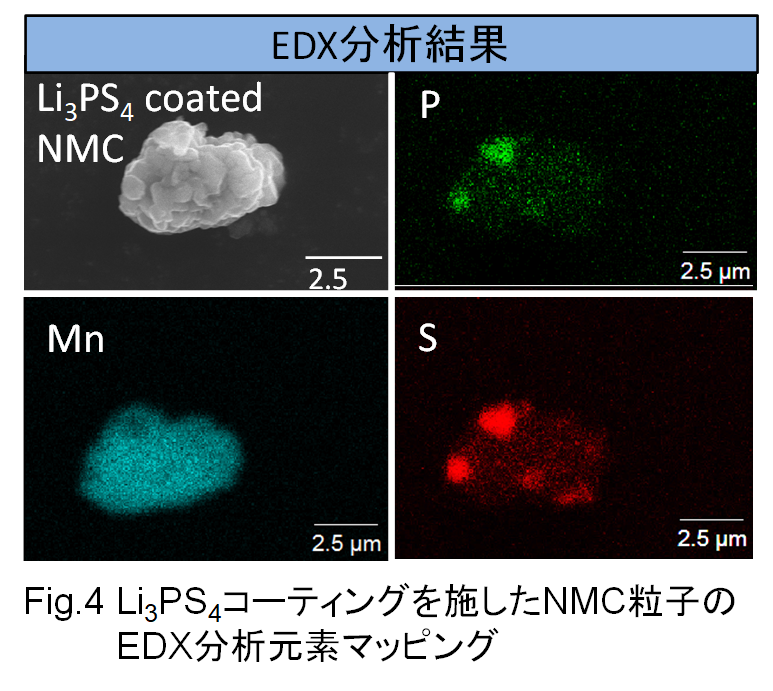
このように、非晶質Li3PS4をコーティングした粒子について、EDX測定により元素マッピング測定を行った結果をFig.4に示します。図中の水色はNMC粒子に含まれるNi元素のまっぽんぐ結果であり、粒子全体からシグナルが得られています。また、緑は固体電解質であるLi3PS4を構成しているリン元素、さらに赤は硫黄元素のマッピング結果です。リン元素のシグナルも、硫黄元素のシグナルも、Ni元素とほぼ同じ位置から観測されるため、NMC粒子表面にLi3PS4がコーティングされていることがわかります。
さらに、緑で示したリンや赤で示した硫黄のシグナルが強い部分が観測されますが、電子顕微鏡(SEM)像と照らし合わせて考えると、この部分は固体電解質であるLi3PS4粒子が析出している部分であると考えられます。今回行ったコーティング方法では、Li3PS4を完全に均一な膜としてコーティングできているわけではなく、NMC粒子全体をLi3PS4が覆っているものの、一部Li3PS4粒子として析出している部分もあることがわかります。しかしながら析出したLi3PS4粒子は、NMC粒子と比較して小さな粒子となっていることがわかります。
このようにして作製したLi3PS4でコーティングされたNMCを用いて作製した全固体電池の充放電曲線をFig.5に示します。図中、赤い実線がコーティングを施したNMCを用いた全固体電池の充放電曲線、青い実線は未処理のNMC粒子と別途作製したLi3PS4固体電解質粉末を混合した電極合材を用いた全固体電池の充放電曲線です。縦軸は電池電圧、横軸は正極材料中のNMC含有量1gあたりの電気化学容量です。図からわかるように、充電曲線はコーティングを施したNMCを用いた電池と未処理のNMCを用いた電池で、ほとんど変化がありませんが、放電曲線において、コーティング処理を施したNMCが約 150 mAhg-1の放電容量を示していることに対して、未処理のNMCを用いた場合は、約 130 mAhg-1程度の放電容量になっています。このように、Li3PS4をコーティングしたNMCを用いた全固体電池の方が優れた放電特性を示すことがわかります。
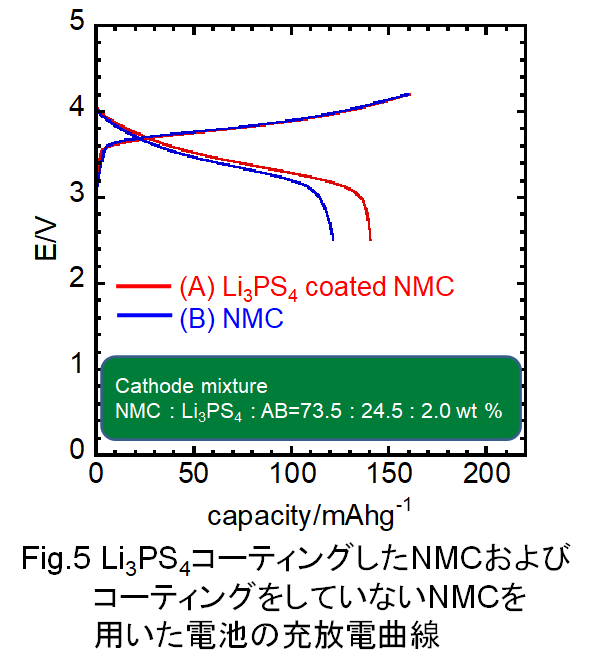
Fig.6には、Li3PS4のコーティング量を変化させたときの放電容量の変化を示します。横軸はLi3PS4のコーティング量を示しています。左の図の縦軸は正極活物質として用いたNMC 1g当たりの放電容量を、右の図では、固体電解質を含んだ正極合剤 1g当たりの放電容量に換算したものを縦軸として示しています。また、参考のために、未処理のNMCと別途作製したLi3PS4を混合した電極合材を用いた電池の放電容量を青印で示しています。この場合、添加したLi3PS4粉末の量を横軸としています。
Fig.6の左図に示したNMC 1g当たりの放電容量の図から、正極合剤中に固体電解質であるLi3PS4を20 wt% 以上加えなければ、電池の放電容量が極端に小さくなってしまうことがわかります。これは正極合剤中にイオン伝導パスが必要であることを示しています。また、固体電解質であるLi3PS4を30 wt% 程度加えることで、活物質であるNMC 1g当たりの電気化学容量はほぼ一定の値を示すようになり、Li3PS4をコーティングしたNMCを用いた場合は、約145 mAhg -1程度で飽和すること、未処理のNMCを用いた場合には、約145 mAhg -1程度で飽和することがわかります。このようにLi3PS4をコーティングしたNMCを用いた方がより大きな電気化学容量を示すことは、正極合剤の中で、正極活物質であるNMCと固体電解質であるLi3PS4との接触が重要であることを示唆するものです。
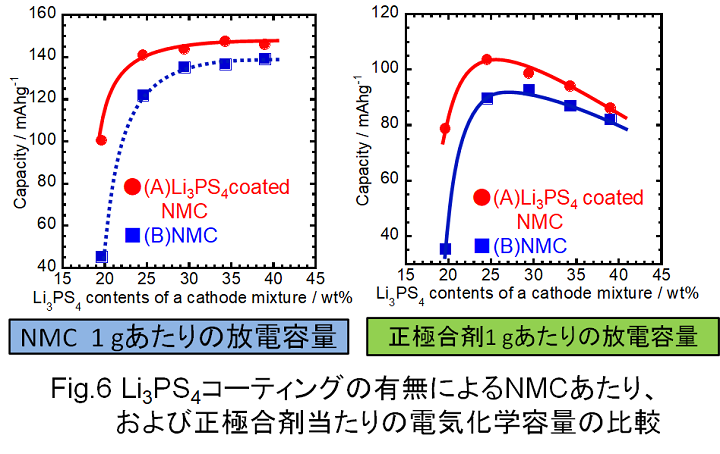
さらに、Fig.6の右図には、正極活物質及び固体電解質を合わせた総重量に対する電気化学容量を縦軸にプロットしています。正極合剤中に含まれる固体電解質量が多くなれば、活物質であるNMCが有効に機能するようになりますが、固体電解質の量が多くなれば正極合剤の総重量が増加してしまい、電池としての重量当たりの電気化学容量が犠牲になってしまいます。このような観点から見ると、正極合剤に添加するべき固体電解質の量は最適地があるはずです。図からわかるように、Li3PS4の添加量が 24 wt%付近で、正極合剤1g当たりの放電容量は極大値を示しています。この付近の添加量が最適値であることがわかります。また、Li3PS4をコーティングしたNMCを用いる方が未処理のNMCを用いた場合よりも大きな放電容量を示しており、より高エネルギー密度な電池を構築できることがわかります。
